 Wasserelektrolyse
Wasserelektrolyse
Elektrolyse (vom griechischen lysis = spalten, auflösen) ist die Auflösung eines chemischen Elements unter dem Einfluss von Elektrizität.
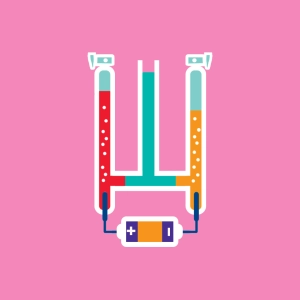
Der Hoffmannsche Wasserzersetzungsapparat (Voltameter) ist ein Apparat, der die Untersuchung der Wasserelektrolyse ermöglicht. Zwar spricht man von Wasserelektrolyse, allerdings ist pures Wasser zur Elektrolyse eher ungeeignet. Um eine gute Leitfähigkeit zu gewährleisten, sollte ein Elektrolyt wie Schwefelsäure H2SO4 beigefügt werden.
Unter dem Einfluss einer Spannungspotenzialdifferenz kann an den Elektroden eine elektrochemische Reaktion beobachtet werden:
Die Kathode sendet Elektronen aus, die das Wasser nach folgender Reduktionsreaktion auflösen:
2H2O + 2e- → H2 + 2OH-
An der Anode unterliegen die Wassermoleküle folgender Oxidationsreaktion:
2H2O → O2 + 4H++ 4e-
In Summe ergibt sich folgende Gleichung für die Aufspaltung:
2H2O → O2 + 2H2
Die Reaktion produziert doppelt so viele Dihydrogene wie Dioxygene. Das Avogardische Gesetz macht erklärbar, dass das Gasvolumen in der linken Röhre (H2) doppelt so groß wie das in der Rechten (O2) ist.
