 Galvanische cel
Galvanische cel
Al heel lang is bekend dat de materie elektrisch geladen kan raken. Desondanks is het niet eenvoudig om een ladingsscheiding in stand te houden die een stroomkring mogelijk maakt. Pas in de 18e eeuw werd met de Volta-batterij de eerste stroomgenerator gerealiseerd.
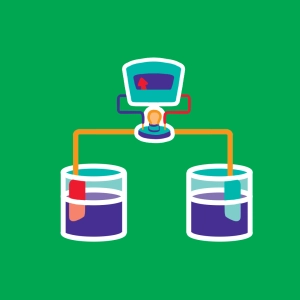
In 1836 vond John Daniell (1790-1845), een Britse natuurkundige, een nieuwe batterij uit, bestaande uit twee compartimenten gevuld met waterige oplossingen van respectievelijk kopersulfaationen met daarin een koperen plaatje en zinksulfaationen met daarin een plaatje van zink.
De twee compartimenten zijn verbonden door een zoutbrug. Met deze opstelling kan een duurzame spanning van 1.1 V worden gegenereerd.
